Foto: Pixabay
Samo jedno od brojnih neobičnih svojstava vode (H2O), uslijed kojeg je život na Zemlji opstao, je to da za razliku od većine ostalih jedinjenja, ona u tečnom stanju ima veću gustinu nego u čvrstom, kada je zaleđena. Što dovodi to toga da led umjesto da potone, ostaje da pluta na njenoj površini.
Da kojim slučajem nema ove hemijske anomalije vode, rijeke i jezera bi se smrzavali od vrha do dna umjesto samo na površini, što omogućava životu da prezimljava u toplijoj vodi ispod tačke mržnjenja. Da nema ove anomalije, pitanje je da li bi život uopšte i imao svoju evolucionu istoriju.
Otkuda ova anomalija, zašto je led lakši od vode?
Šta su i zašto nastaju hidrogenske veze među molekulima vode?
Hidrogenska veza je posljedica elektronegativnost atoma. Elektronegativnost možemo najjednostavnije definisati kao “snagu kojom jezgro atoma privlači elektrone ka sebi” Veoma elektronegativan atom, kao što je recimo atom fluora, teži da privuče ka sebi ne samo svoje sopstvene elektrone, već i elektrone iz kovalentne veze sa drugim atomima.
Kada se susretnu dva atoma koji nemaju jednaku elektronegativnost, elektronegativniji element teži da ka sebi privuče elektrone iz njihove veze. Kod molekula vode, imamo kisonik (O) koje ima znatno veću elektronegativnost od atoma vodonika (H). Što dovodi do toga da se elektroni u molekulu vode kreću tako da duže ostaju na strani kiseonika a manje na strani vodonika. Jedna strana molekula postaje pozitivno a druga više negativno naelektrisana.
Ako bi smo to grafički prikazali izgledalo bi ovako:
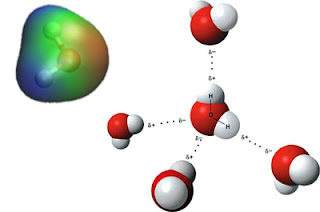
Važna stvar je to što su ove hidrogenske veze znatno slabije od kovalentnih. Zbog ovoga, voda se ponaša kao velika trodimenzionalna mreža, koja je u stanju da se neprestano reorganizuje.
Na temperaturi nižoj od 0 stepeni celzijusa ova trodimenzionalna mreža usporava kretanje molekula sve dok ne uspostavi pravilan oblik u kojoj je svaki molekul vode vezan hidrogenskom vezom za 4 okolna molekula vode, odnosno dok ne postane led. Dok u tečnom stanju slučajni pokreti molekula izazivaju stalno pucanje hidrogenskih veza, i stvaranje novih, hiljadama milijardi puta u sekundi. U tečnom stanju trodimenzionalna mreža omogućava molekulima H20 da ostvare i više od 4 veze sa susjednim molekulom. Upravo taj nepravilan oblik rešetke omogućava tečnoj vodi da ima veću gustinu.
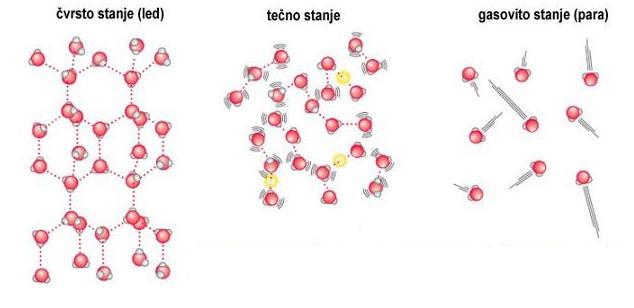
Pored ove anomalije za koju je prije svega zahvalna polarnost molekula vode, postoji i još jedna izuzetno važna. Polarnost omogućava da voda bude glavni medijum za transportovanje velike količine disosovanih jona, kao i različitih polarnih organskih jedinjenja (sećera, amino kiselina, proteina), koji čine osnovne gradivne blokove svih živih organizama na planeti.

